Tauchphysik in der Nussschale
Gesetze des Tauchens einmal ganz ohne Mathematik
Die grundlegenden physikalischen Zusammenhänge des Tauchens sollte jeder Taucher bei seiner Grundausbildung gelernt haben. Wer weiss dies noch alles? Hier eine kleine Auffrischung. Ich wurde von der Redaktionschefin ermahnt, alle Formeln aus diesen Artikel zu entfernen.
Schweredruck
Der absolute Druck auf Tauchtiefe ist die Summe des atmosphärischen Druckes an der Oberfläche und des Druckes der sich über dem Taucher befindlichen Wassersäule. Ein Kubikmeter Luft wiegt auf Meereshöhe und 25 °C Umgebungstemperatur 1.184 kg, ein Kubikmeter Wasser eine 1 t. Wasser ist somit rund 800 mal dichter als Luft. Zehn Meter Wassersäule entspricht etwa dem Druck unserer Atmosphäre. Mit steigener Wassertiefe steigt der Druck linear. Mit zunehmender Höhe über Meer sinkt der Luftdruck. Siehe Tabelle 1.
| Tiefe | Umgebungsdruck bei Meereshöhe | ||||||
|---|---|---|---|---|---|---|---|
| 0 m | 500 m | 1000 m | 1500 m | 2000 m | 2500 m | 3000 m | |
| 0 m | 1 bar | 0.95 bar | 0.89 bar | 0.84 bar | 0.78 bar | 0.74 bar | 0.69 bar |
| 10 m | 2 bar | 1.95 bar | 1.89 bar | 1.84 bar | 1.78 bar | 1.74 bar | 1.69 bar |
| 20 m | 3 bar | 2.95 bar | 2.89 bar | 2.84 bar | 2.78 bar | 2.74 bar | 2.69 bar |
| 30 m | 4 bar | 3.95 bar | 3.89 bar | 3.84 bar | 3.78 bar | 3.74 bar | 3.69 bar |
| 40 m | 5 bar | 4.95 bar | 4.89 bar | 4.84 bar | 4.78 bar | 4.74 bar | 4.69 bar |
Statischer Auftrieb
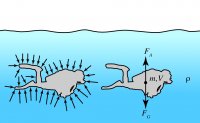
Die statische Auftriebskraft ist eine in Flüssigkeiten oder Gasen der Schwerkraft entgegengesetzte Kraft. Sie wird durch die Verdrängung des umgebenden Mediums hervorgerufen. Die Ursache für die Auftriebskraft liegt darin, dass der hydrostatische Druck von der Tiefe des betrachteten Ortes abhängt. An der Unterseite eines Körpers wirkt ein höherer Umgebungsdruck als an der Oberseite und drückt deshalb den Körper nach oben.
Ist die Masse des durch den Körper verdrängten Wassers gleich gross wie die Masse des Körpers selbst, heben sich die beiden Kräfte auf, d. h. der Körper erscheint schwerelos. Dieses Gesetz wurde vor über 2200 Jahren vom griechischen Gelehrten Archimedes von Syrakus bei einem Bad in der Wanne entdeckt und nach ihm benannt.
Für einen Taucher ist der statische Auftrieb besonders für die Tarierung interessant:
- Sinkt ein Taucher, so ist er schwerer als das von ihm verdrängte Wasser. Er muss sein Volumen vergrössern, um wieder eine neutrale Tarierung zu erlangen. Hierfür wird die notwendige Menge Luft in die Tarierweste geblasen, welche sich dadurch aufbläht und das Volumen vergrössert.
- Steigt ein Taucher, so ist er leichter als das von ihm verdrängte Wasser. Er muss sein Volumen verringern, um wieder eine neutrale Tarierung zu erlangen. Hierzu muss Luft aus der Tarierweste abgelassen werden.
- In einem Fluid mit höherer Dichte (Salzwasser gegenüber Süsswasser) benötigt ein Taucher mehr Masse, um eine neutrale Tarierung zu erlangen.
Gesetze idealer Gase
Bei Gasen sind Druck, Volumen und Temperatur direkt voneinander abhängig, wobei Temperatur ist die absolute Temperatur in Kelvin zu verwenden ist (0 °C = 273.15 K). Diese Gesetze wurden von unterschiedlichen Personen bei experimentellen Untersuchungen unabhängig voneinander entdeckt. Wie der Titel schon vermuten lässt, gelten diese Gesetze nur für “ideale Gase”, bei denen die Moleküle als ausdehnungslose Massepunkte angenommen werden, welche ausser elastischen Stössen keinerlei Wechselwirkung miteinander eingehen. Die für Taucher relevanten Gase verhalten sich bei den herrschenden Drücken und Temperaturen genügend linear, weshalb hier die Gesetze idealer Gase angewendet werden dürfen. Die Abweichungen liegen innerhalb der Messtoleranzen von Finimetern.

Gesetz von Boyle-Mariotte: Bei konstanter Temperatur (isotherme Zustandsänderung) ist der Druck umgekehrt proportional zum Volumen.
- Die Luftbläschen im Neoprenanzug, sowie die Luft im Jacket werden mit zunehmender Tiefe und Druck mehr zusammen gequetscht und man verliert an Auftrieb. Deshalb muss das Jacket beim Abtauchen mit Luft gefüllt werden, um den Taucher schwerelos zu tarieren. Bei einem Apnoe-Taucher wird die Lunge bis auf die Grösse einer Faust zusammengequetscht.
- Beim Auftauchen dehnt sich die Luft im Jacket und Trockenanzug aus. Dies gilt ebenfalls für die Luft in der Lunge und in den Eingeweiden. Darum beim Auftauchen nie den Atem anhalten und keinen Furz und Rülpser verklemmen! Am allerwichtigsten ist der in den Körperflüssigkeiten und Geweben gelöste während dem Tauchen angereicherte Stickstoff. Bei zu schnellem Auftauchen (schneller als 10 m/min) können die grösser werdenen Bläschen im Blut nicht mehr abgeatmet werden.
Gesetz von Amontons: Bei konstantem Volumen (isochore Zustandsänderung) ist der Druck direkt proportional zur Temperatur.
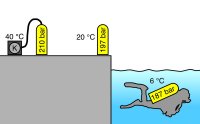
- Nach dem Füllen ist die Flasche wegen der Kompression (Joule-Thomson-Effekt) spürbar warm. Wenn sie dann eine Zeitlang abgekühlt ist, sinkt der Druck. Wer die Kapazität optimal nutzen will, der füllt sie das erste Mal unmittelbar nach dem Tauchgang, lagert sie an einem kühlen Ort und füllt vor dem nächsten Tauchgang noch den Rest nach.
- Wenn mit einer warmen Flasche ins kalte Wasser gesprungen wird, sinkt der Druck in der Flasche. Von anfänglich 210 bar direkt nach dem Füllen sind auf einmal nur noch 187 bar übrig. Es ist aber noch immer dieselbe Menge Luft in der Flasche. Die Druckminderung muss bei der Luftvorratberechnung für die Tauchgangsplanung berücksichtigt werden.
Gesetz von Gay-Lussac: Bei konstantem Druck (isobare Zustandsänderung) ist das Volumen direkt proportional zur Temperatur.
- Findet jetzt nicht direkt beim Tauchen Anwendung, aber wer an einem heissen Sommertag das Planschbecken seiner Kinder mit Druckluft aus der Tauchflasche füllen will, soll es anfangs nicht zu prall füllen. Das ausströmende Gas ist kalt und wenn es sich in der Sonne erwärmt, dehnt es sich aus und füllt dann die Luftkammern des Planschbeckens prallvoll.
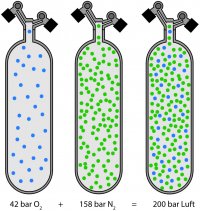
Gesetz von Avogadro: Die Stoffmenge ist bei unterschiedlichen Gasen mit bei gleichem Volumen, gleichem Druck und gleicher Temperatur ebenfalls dieselbe. Woraus sich die universelle Gaskonstante ergibt.
- In zwei Flaschen gleicher Grösse und gleichem Druck und bei gleicher Temperatur befinden sich dieselbe Anzahl Gasmoleküle, unabhängig davon, um welches Gas es sich dabei handelt. Dies ist wichtig für die Berechnung des Verhältnisses beim Mischen von Gasen.
Gesetz der Homogenität: Ein ideales Gas besitzt überall dieselbe Dichte und das Volumen ist bei konstantem Druck und konstanter Temperatur proportional zur Stoffmenge.
- Bei Gasgemischen (Luft, Nitrox, Trimix) sind die einzelnen Gase überall in der Flasche gleichförmig verteilt. Der Sauerstoff sinkt nicht mit der Zeit auf den Flaschenboden, weil er schwerer als Stickstoff ist. Die Tauchflasche muss also nicht vor Gebrauch geschüttelt werden.
Luftverbrauch
Das Lungenvolumen eines Menschen beträgt im Schnitt drei bis vier Liter. Weltrekordler im Apnoetauchen können sogar ein Lungenvolumen bis zehn Liter erreichen. Ein Mensch atmet im Ruhezustand etwa 12 bis 18 mal pro Minute und pro Atemzug etwa einen halben Liter Luft, was ein Atemminutenvolumen (AMV) von ungefähr 6-9 l/min. Bei leichten körperlichen Tätigkeiten (z. B. gehen) steigt der Luftverbrauch auf etwa 25 Liter pro Minute. Bei sehr starker körperlicher Anstrengung und Panik kann der Luftverbrauch auf etwa 80 Liter pro Minute ansteigen. Geübte Taucher, die entspannt unterwegs sind, haben ein AMV von etwa 10-15 l/min.
Unter erhöhtem Umgebungsdruck ist das Atemminutenvolumen auf Tauchtiefe direkt proportional zum Druck, da komprimierte Luft geatmet wird. Dieser ist in Tabelle 2 dargestellt. Der Luftverbrauch beim auf- oder abtauchen mit konstanter Geschwindigkeit errechnet sich aus dem mittleren Druck zwischen den beiden Tauchtiefen.
| Tiefe | AMV | Zeit für 50 bar bei Flaschengrösse | |||
|---|---|---|---|---|---|
| 7 l | 10 l | 12 l | 15 l | ||
| 0 m | 25 l/min | 14’ 00’’ | 20’ 00’’ | 24’ 00’’ | 30’ 00’’ |
| 10 m | 50 l/min | 7’ 00’’ | 10’ 00’’ | 12’ 00’’ | 15’ 00’’ |
| 20 m | 75 l/min | 4’ 40’’ | 6’ 40’’ | 8’ 00’’ | 10’ 00’’ |
| 30 m | 100 l/min | 3’ 30’’ | 5’ 00’’ | 6’ 00’’ | 7’ 30’’ |
| 40 m | 125 l/min | 2’ 48’’ | 4’ 00’’ | 4’ 48’’ | 6’ 00’’ |
| 50 m | 150 l/min | 2' 20’’ | 3’ 20’’ | 4’ 00’’ | 5’ 00’’ |
Partialdrücke
In einem Gasgemisch entspricht der Partialdruck jeder einzelnen Komponente dem Druck, welchen diese bei alleinigem Vorhandensein im betreffenden Volumen ausüben würde. Das Gesetz von Dalton besagt, dass die Summe aller Partialdrücke gleich dem Gesamtdruck des Gemisches ist.
Für Luft folgert daraus, dass der Druck von Luft gleich der Summe der Drücke von Stickstoff, Sauerstoff, Argon, Kohlendioxid und anderer Spurengase ist. Da die Anteile von Argon, Kohlendioxid und anderer Spurengase zusammen weniger als 1 % Volumenanteil der Atemluft ausmachen, werden sie für die Berechnung von Tauchgängen vernachlässigt. Die Zusammensetzung von Luft vereinfacht sich dadurch auf den gerundeten Anteil von Stickstoff 79 % und den von Sauerstoff 21 %.
Wirkung der Atemgase auf den Menschen
Der menschliche Organismus hat sich über viele Generationen der Zusammensetzung der Erdatmosphäre und dem in der gewohnten Umgebung herrschenden Drücke angepasst. Wird von diesen abgewichen, kann es zu Komplikationen kommen:
- In grossen Höhen ist der Atmosphärendruck und somit auch Sauerstoffpartialdruck niedriger, was zu einer Sauerstoff-Unterversorgung und zur Höhenkrankheit führen kann. Aus diesem Grunde müssen sich Bergsteiger erst anklimatisieren.
- Einatmung von Luft unter erhöhtem Umgebungsdruck führt zu einer Sättigung der Körperflüssigkeiten und des Gewebes mit Stickstoff, da dieser vom Körper nicht verarbeitet werden kann.
- Ist der Stickstoffpartialdruck zu gross, so kann dieser narkotisch wirken (Tiefenrausch). Erste Anzeichen einer Stickstoffnarkose können schon bei einem Stickstoffpartialdruck von 3-4 bar auftreten, doch jeder Mensch reagiert unterschiedlich darauf. Allgemein gilt, dass 5 bar nicht überschritten werden soll.
- Ist der Sauerstoffpartialdruck zu gross und wird über einen längeren Zeitraum eingeatmet, so kann dieser toxisch wirken. Er wirkt als erstes auf das zentrale Nervensystem (ZNS). Die Symptome einer Sauerstoff-Vergiftung sind Augenflimmern, Übelkeit, Muskelzuckungen, Epilepsiänliche Anfälle bis zur Bewusstlosigkeit. Sie können schleichend auftreten oder aber auch plötzlich.
Um die oben genannten Nebeneffekte zu reduzieren werden für das Tauchen je nach Anwendung und Tiefe unterschiedliche Gasmischungen verwendet. Das im Sporttauchen am häufigsten verwendete ist Nitrox mit 32 % Sauerstoffanteil. Durch den geringeren Anteil von Stickstoff die Stickstoffsättigung und somit das Risiko einer Stickstoffnarkose und einer Dekompressionskrankheit verringert. Für grosse Tiefen wird der Stickstoff teilweise bis ganz durch Helium ersetzt und auch der Sauerstoffanteil reduziert. Dieses Gasgemisch darf dann nicht oberhalb einer für den Mix festgelegten Grenze eingeatmet werden.
Die allgemeine Empfehlung für den maximal zulässigen Sauerstoffpartialdruck lautet:
- 1.6 bar für gemütliche Tauchgänge im warmen Wasser ohne körperliche Anstrengung oder Stress, sowie für Atemgemische während eines Dekompressionsstops.
- 1.4 bar für anspruchsvolle Tauchgänge im kaltem Wasser oder ohne ausreichenden Kälteschutz, mit körperlicher Anstregnung und Stress. Dies ist der für die meisten Situationen empfohlene Grenzwert.
- 1.2 bar für konservative Tauchgangsplanung und für in grosser Tiefe eingesetzte Gasmischungen.
| Tiefe | Druck O2 | Druck N2 |
|---|---|---|
| 0 m | 0.21 bar | 0.79 bar |
| 10 m | 0.42 bar | 1.58 bar |
| 20 m | 0.63 bar | 2.37 bar |
| 30 m | 0.84 bar | 3.16 bar |
| 40 m | 1.05 bar | 3.95 bar |
| 50 m | 1.26 bar | 4.74 bar |
| 60 m | 1.47 bar | 5.53 bar |
| 70 m | 1.68 bar | 6.32 bar |